ความหมายแรงยึดเหนี่ยวระหว่างอะตอมภายในโมเลกุลหรือระหว่างโมเลกุลด้วยกันเอง พันธะเคมีสามารถแบ่งได้หลายประเภท เช่น พันธะโควาเลนต์ พันธะโคออดิเนทโควาเลนต์ พันธะโลหะ พันธะไอออนิก พันธะไฮโดรเจน ฯลฯ
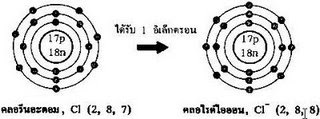
เกิดขึ้นได้เนื่องจากการให้และรับอิเล็กตรอนระหว่างอะตอมของธาตุ ๒ ชนิดที่แตกต่างกัน อะตอมของธาตุที่เป็นฝ่ายให้อิเล็กตรอนออกไป ทำให้ตัวของมันเองมีจำนวนอิเล็กตรอนน้อยลง จึงแสดงอำนาจไฟฟ้าบวกออกมา ส่วนอะตอมของธาตุที่เป็นฝ่ายได้รับอิเล็กตรอนก็จะกลายเป็นประจุลบ ทำให้เกิดแรงดึงดูดระหว่างขั้วที่แตกต่างกันจึงเรียกว่า Ionic หรือ Electrovalent Bondingพันธะไอออนิก คือ พันธะที่เกิดขึ้นอันเนื่องมาจากแรงดึงดูดทางไฟฟ้าสถิตระหว่างไอออนบวก(cation) และไอออนลบ(anion) อันเนื่องมาจากการถ่ายโอนอิเล็กตรอน จากโลหะให้แก่อโลหะ โดยทั่วไปแล้วพันธะไอออนิกเป็นพันธะที่เกิดขึ้นระหว่างโลหะและอโลหะ ทั้งนี้เนื่องจากว่าโลหะมีค่าพลังงานไอออไนเซชัน(ionization energy)ต่ำ แต่อโลหะมีค่าสัมพรรคภาพอิเล็กตรอน(electron affinity)สูง ดังนั้นโลหะจึงมีแนวโน้มที่จะให้อิเล็กตรอน และอโลหะมีแนวโน้มที่จะรับอิเล็กตรอนเมื่อโลหะเสียอิเล็กตรอนก็จะกลายเป็นไอออนบวก
ประจุบวกและลบที่เกิดขึ้นก่อให้เกิดแรงดึงดูดทางไฟฟ้าซึ่งกันและกันเกิดเป็นพันธะไอออนิก และเพื่อความเข้าใจมากขึ้นขออธิบายการเกิดพันธะไอออนิกระหว่าง อะตอมของโซเดียม และ คลอไรด์พันธะอิออนิก เป็นพันธะที่แข็งแรง ซึ่งจะมีความแข็งแรง (Strong) แต่เปราะ (Brittle) จุดหลอมเหลวและจุดเดือดสูง ตัวอย่างเช่น การเกิดพันธะระหว่างโซเดียม (Na)กับคลอรีน (Cl) หรือออกไซด์ของโลหะทั้งหลาย11Na มีการจัดเป็น 1s2 2s2 2p6 3s117Cl มีการจัดเป็น 1s2 2s2 2p6 3s2 3p5โซเดียมจะให้อิเล็กตรอนแก่คลอรีนจำนวน 1 ตัวซึ่งทำให้โซเดียมเสถียรและมีปะจุบวกหนึ่งส่วนคลอรีนรับปะจุจากโซเดียมมา 1 ตัวทำให้คลอรีนเสถียรและมีปะจุลบหนึ่ง ดังนั้นจึงทำให้เกิดแรงดึงดูดทางไฟฟ้าระหว่างคลอรีนกับโซเดียม
พันธะโควาเลนซ์ (Covalent Bonding)
เป็นพันธะที่ใช้อิเล็กตรอนวงนอกสุดร่วมกันของสองอะตอมที่เข้ามาใกล้กัน เพื่อให้จำนวนอิเล็กตรอนในวงนอกสุดครบจำนวนและเกิดเสถียร ซึ่งเป็นพันธะที่แข็งแรง จุดเดือดและจุดหลอมเหลวสูง แต่โดยธรรมชาติจะมีความเปราะ มีสารหลายชนิดที่มีพันธะแบบนี้และมีคุณสมบัติแตกต่างจากที่กล่าวมา ตัวอย่างเช่น โมเลกุลของก๊าซ H2 N2 O2 Cl2พันธะโควาเลนซ์ เป็นพันธะที่เกิดจากอะตอมทั้งสองใช้เวเลนซ์อิเล็กตรอนร่วมกัน ซึ่งเกิดได้จาก
- ธาตุอโลหะ กับ ธาตุอโลหะ เช่น HCl NH3
- ธาตุกึ่งโลหะ กับ ธาตุอโลหะ เช่น SiO3 BCI3
- ธาตุโลหะ กับ ธาตุอโลหะ เช่น BeCl2 AgCI3
การสังเกตลักษณะการเกิดพันธะโควาเลนซ์ มีดังนี้
- มักเกิดจากอะตอมในหมู่เดียวกัน เช่น H – H Cl - C
- เกิดจากอะตอมในหมู่ใกล้เคียงกัน เช่น CO2
- เกิดจากอะตอมในหมู่ต่าง ๆ กับอะตอม H เช่น CH4
การเกิดโมเลกุลโควาเลนต์นั้น จะเสถียรขึ้นได้ เป็นเพราะ Valence e- ของแต่ละอะตอมหลังเกิดพันธะ แล้วจะมี Valence e- ครบ 8 ตัว เหมือนแก๊สเฉื่อย ยกเว้น H ที่หลังเกิดพันธะ Valence e- ครบ 2 ตัวเหมือน Heตัวอย่างการเกิดพันธะของ ก๊าซคลอรีน ( Cl2 )17Cl มีการจัดเป็น 1s2 2s2 2p6 3s2 3p5จะพบว่าคลอรีนจะขาดอิเลกตรอนวงนอกอีก 1 ตัวจึงจะครบ 8 ดังนั้นเมื่อคลอรีนเข้าทำปฏิกิริยากันเองจึงใช้อิเลกตรอนร่วมกันฝ่ายละ 1 ตัว รวมเป็น 1 คู่ ทำให้อิเล็กตรอนวงนอกสุดครบ 8 และมีความเสถียร ดังภาพ
ภาพแสดงการเกิดพันธะโควาเลนต์ของก๊าซคลอรีน
แรงดึงดูดของพันธะโควาเลนต์นอกจากจะขึ้นกับระยะทางแล้วยังขึ้นอยู่กับมุมระหว่างพันธะด้วย
ภาพแสดงแรงดึงดูดของมุมระหว่างพันธะของพันธะโควาเลนต์แบบต่าง ๆพันธะโลหะ (Metallic Bonding)เป็นการยึดเหนี่ยวกันของอะตอมโลหะมีลักษณะคล้ายๆ กับพันธะโควาเลนซ์์ ต่างกันอยู่ที่ว่าอะตอมทั้งหมดของโลหะที่กระจายอยู่ต่างก็มีการใช้อิเล็กตรอนร่วมกันทำให้อิเล็กตรอนร่วมกันทำให้อิเล็กตรอนมีอิสระในการเคลื่อนที่ เนื่งจากอะตอนของโลหะมักจะมีวาเลนท์อิเล็กตรอน (Valence electron) จำนวนน้อยจึงมักจะหลุดออกจากอะตอมได้ง่าย อิเล็กตรอนบางส่วนจะยึดเหนี่ยวแน่นอยู่กับนิวเคลียส กลุ่มอิเล็กตรอนที่หลุดออกมาจะจับกลุ่มกันล้อมรอบอิออนบวก (อะตอมที่สูญเสียอิเลคตรอนวงนอกสุด) เรียกว่าอิเล็กตรอนอิสระ (Free electron) หรือกลุ่มของอิเล็กตรอน (Eledctron Clound) ซึ่งเคลื่อนที่อยู่ตลอดเวลา ส่วนอะตอมที่ขาดอิเล็กตรอนวงนอกสุดนี้จะกลายเป็นอิออนบวก ดังนั้นในเนื้อวัสดุประเภทนี้จะประกอบด้วยกลุ่มประจุบวก (Positive ion) สลับกับกลุ่มประจุลบ (Negative ion) ดึงดูดซึ่งกันและกัน ซึ่งการยึดเหนี่ยวแบบนี้เรียกว่า พันธะโลหะการเกิดพันธะเคมี1 โลหะมีค่าพลังงานไอออไนเซชั่นต่ำมาก แสดงว่าอิเล็กตรอนของโลหะจะหลุดออกไปได้ง่าย เมื่อวาเลนซ์อิเล็กตรอนหลุดออกไป ก็จะเหลืออนุภาคบวกดังนี้
อะตอมโลหะทุกอะตอมเป็นตัวให้อิเล็กตรอนทั้งสิ้นดังนั้นจะไม่มีอะตอมใดเลยที่ได้รับอิเล็กตรอน
2 โลหะมีเวเลนซ์อิเล็กตรอนน้อย ดังนั้นอิเล็กตรอนที่หลุดออกไป จะมีเีพียง 1,2,3 ตัวเท่านั้น3 โลหะมีค่าโคออร์ดิเนชั่นนัมเบอร์สูง ซึ่งเท่ากับ 8 หรือ12 หมายความว่า อะตอมหนึ่งจะมีอะตอมอื่นรอบล้อม 8 ถึง 12 อะตอมดังนั้นการนำอิเลคตรอนมาใช้ร่วมกันเป็นอิเล็กตรอนคู่ในลักษณะของพันธะโคเวเลนต์จึงเป็นไปไม่ได้ดังนั้นการเกิดพันธะโลหะควรเป็นไปในลักษณะที่ว่าเวเลนซ์อิเล็กตรอนของอะตอมโลหะที่หลุดออกไปจะไม่เป็นของอะตอมใดอะตอมหนึ่งโดยเฉพาะแต่จะเป็นของอะตอมทั้งหมด โดยที่อิเล็กตรอนจะเคลื่อนที่ไปยังอะตอมนี้บ้าง อะตอมโน้นบ้าง ในผลึกของโลหะจึงเป็นการเอาอนุภาคบวกมาเรียงกัน ไว้อย่างมีระเบียบ และมีเวเลนซ์อิเล็กตรอนเคลื่อนที่ไปมาได้ทั่วอนุภาคบวกทั้งหมด หรืออาจกล่าวได้ว่า อนุภาคบวกเหล่านั้นจมอยู่ในทะเลอิเล็กตรอน แรงดึงดูดระหว่างอนุภาคบวกกับอิเล็กตรอนเรียกว่า "พันธะโลหะ" ซึ่งมีแรงยึดเหนี่ยวระหว่างพันธะแข็งแรงมาก
ภาพแสดงการเกิดพันธะโลหะ
การที่โลหะมีพันธะโลหะจึงทำให้โลหะมีสมบัติทั่วไป ดังนี้
- โลหะเป็นตัวนำไฟฟ้าที่ดี เพราะอิเล็กตรอนเคลื่อนที่ได้ง่าย
- โลหะมีจุดหลอมเหลวสูง เพราะเวเลนต์อิเล็กตรอนของอะตอมทั้งหมดในก้อน
- โลหะยึดอะตอมไว้อย่างเหนียวแน่น
- โลหะสามารถตีแผ่เป็นแผ่นบางๆได้ เพราะมีกลุ่มเวเลนต์อิเล็กตรอนทำหน้าที่ยึดอนุภาคให้เรียงกันไม่ขาดออกจากกัน
- โลหะมีผิวเป็นมันวาว เพราะกลุ่มอิเล็กตรอนที่เคลื่อนที่โดยอิสระมีปฏิกิริยาต่อแสง จึงสะท้อนแสงทำให้มองเห็นเป็นมันวาว
- สถานะปกติเป็นของแข็ง ยกเว้น Hg เป็นของเหลว
- โลหะนำความร้อนได้ดี เพราะอิเล็กตรอนอิสระเคลื่อนที่ได้ทุกทิศทาง
พันธะไฮโดรเจนพันธะไฮโดรเจน คือ แรงดึงดูดระหว่างโมเลกุลที่เกิดจากไฮโดรเจนอะตอมสร้างพันธะโคเวเลนต์ กับอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีสูงๆและมีขนาดเล็ก ได้แก่ F , O และ N แล้วเกิดพันธะโคเวเลนต์มีขั้วชนิดมีสภาพขั้วแรงมาก ทั้งนี้เนื่องจากพันธะที่เกิดขึ้นนี้อิเล็กตรอนคู่รวมพันธะจะถูกดึงเข้ามาใกล้อะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูง มากกว่าทางด้านอะตอมของไฮโดรเจนมาก และอะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูง ยังมีอิเล็กตรอนคู่โดดเดี่ยว จึงเกิดดึงดูดกันระหว่างอิเล็กตรอนคู่โดดเดี่ยวกับอะตอมของไฮโดรเจนชึ่งมีอำนาจไฟฟ้าบวกสูงของอีกโมเลกุลหนึ่ง ทำให้เกิดเป็นพันธะไฮโดรเจนตัวอย่างเช่น การเกิดพันธะไฮโดรเจนระหว่างอะตอม ไฮโดรเจน และ ออกซิเจน แสดงได้ดังรูป
โครงสร้างของน้ำที่เป็นของเหลว เกิดจากโมเลกุลของน้ำหลายๆโมเลกุลยึดกันด้วยพันธะไฮโดรเจน แต่ว่ายังไม่ค่อยเป็นระเบียบนักเนื่องจากโครงสร้างของน้ำมีส่วนหนึ่งดึงดูดกันอยู่ด้วยแรงขั้วคู่-ขั้วคู่ และ การสร้างและสลายพันธะไฮโดรเจนตลอดเวลา โครงสร้างของน้ำ (ของเหลว) แสดงได้ดังรูป
แรงยึดเหนี่ยวระหว่างโมเลกุลทั้ง 3 ชนิดนี้ พันธะไฮโดรเจนจัดเป็นแรงยึดเหนี่ยวที่แข็งแรงที่สุด ขณะที่แรงลอนดอนจัดเป็นแรงยึดเหนี่ยวที่แข็งแรงน้อยที่สุด และทั้ง 3 แรงนี้แข็งแรงน้อยกว่าพันธะโคเวเลนต์ พันธะไออนิก และพันธะโลหะมาก
พันธะ(แรง)แวนเดอวาลส์
ในปี ค.ศ.1873 Johannes van der wals ได้อธิบายแรงยึดเหนี่ยวระหว่างโมเลกุลของสารโคเวเลนต์ ซึ่งปัจจุบันแรงแวนเดอวาลส์ จะประกอบด้วยแรงยึดเหนี่ยวระหว่างโมเลกุลแบบต่าง ๆ ดังนี้
1. แรงลอนดอน (Induced dipole - induced dipole forces หรือ Lond force)
2. แรงดึงดูดระหว่างขั้ว (Dipole -pole forces)
3. แรงดึงดูดระหว่างขั้วถาวรกับขั้วที่ถูกเหนี่ยวนำ(dipole - induced dipole forces)
ลักษณะสำคัญของแรงลอนดอน1. แรงลอนดอนเป็นแรงที่เกิดขึ้นช่วงสั้น ๆ และจะเกิดเฉพาะส่วนของโมเลกุลที่เข้าใกล้ชิดกันเท่านั้น โดยเกิดขึ้นระหว่างพื้นผิวของโมเลกุลต่อโมเลกุล2. แรงลอนดอนมีความแข็งแรงประมาณ ถึง ของความแรงของพันธะโคเวเลนต์3. สารโคเวเลนต์ใดที่มีแต่แรงลอนดอนจะพบว่า แรงลอนดอนจะมีผลต่อสมบัติกายภาพบางประการของสาร เช่น จุดเดือด จุดหลอมเหลว กล่าวคือ สารโคเวเลนต์ที่มีแรงลอนดอนมากจุดเดือด และจุดหลอมเหลวสูงกว่าสารโคเวเลนต์ที่มีแรงลอนดอนน้อย
ศึกษาค้นคว้าเพิ่มเติม
http://www.sema.go.th/files/Content/science/k4/0017/periodic/sitanan_s/science/sec01p02.html
http://www.sema.go.th/files/Content/science/k4/0017/periodic/sitanan_s/science/sec01p03.html
http://www.sema.go.th/files/Content/science/k4/0017/periodic/sitanan_s/science/sec01p04.htmlhttp://www.sema.go.th/files/Content/science/k4/0017/periodic/sitanan_s/science/sec01p05.html
http://www.sema.go.th/files/Content/science/k4/0017/periodic/sitanan_s/science/sec01p06.html












ไม่มีความคิดเห็น:
แสดงความคิดเห็น